Діаліз та здоров'я кишківника

Здоров'я пацієнта на діалізі починається з шлунково-кишкового тракту!
Сучасний «бум» наукових досліджень знову орієнтується на здоров'я органів травлення. Вчені доводять, що поліпшення стану шлунково-кишкового тракту, а саме кількісного та якісного складу мікробіоти, покращує загальний стан та зменшує клінічні прояви інших захворювань у хворих на діалізі.
Глосарій термінів:
Мікробіота: товариство мікроорганізмів, що містять бактерії, археї, еукаріоти і віруси.
Мікробіом: сукупність мікроорганізмів, у тому числі їх генів, функціональних генних продуктів і метаболітів у даному біомі, у даний момент часу. Термін «мікробіом» був вперше впроваджений у 2001 р для позначення генетичного матеріалу (ДНК) мікробіоти (агрегат мікробіоти).
Дисбіоз: незбалансована мікробна спільнота, що характеризується кількісними та якісними змінами у складі мікрофлори [1].
Кишківник: самостійний орган або ще одна система життєдіяльності?
Несколько интересных фактов:
- В організмі людини ідентифіковано понад 100 трильйонів бактерій – більше 500 видів (понад 70 дивізій)
- Біомаса мікробів, що заселяють кишечник дорослої людини складає 1,5-3 кг, з них 1 г ендотоксинів
- Лише 10% клітин, які входять до складу організму, є власними людськими клітинами, решта 90% – належать бактеріям, які населяють різні біотопи людини (10:1)
- 70% бактерій мешкає у кишківнику, на їх живлення витрачається 20% поживних речовин, що надходять з їжею та 10% енергії
- Загальний геном мікробіоти кишківника переважає людський геном у понад 150 разів
- Бактеріями ШКТ людини можна прокласти навколо Землі 2,5 рази
Мікробіота кишківника визнана як важливою складовою здоров'я людини, так і впливовим фактором розвитку та прогресування багатьох захворювань, у тому числі й хронічної хвороби нирок:
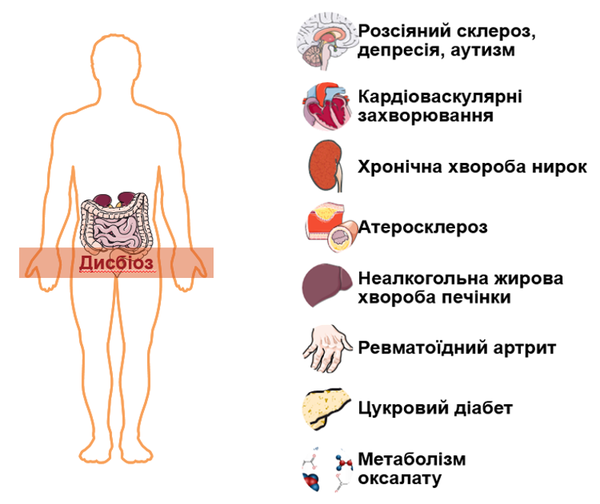
Пацієнти з нирковою недостатністю схильні до недоїдання та енергетичної недостатності через дієтичні обмеження. Крім того, надмірна кількість уремічних токсинів, прийом лікарських засобів (фосфатбіндери, антибіотики, диуретики і т.п.) та модальність діалізу суттєво знижують різноматність кишкової мікробіоти та її кількість, викликаючи дисбіоз. У свою чергу, дисбіоз кишечника ще більше посилює продукцію уремічних речовин та їх попередників і знижує бар’єрну функцію епітелію кишківника [6, 7]. Слід зазначити, що речовини з токсичними властивостями фізіологічно утворюються в кишечнику, але завдяки барʼєрній (захисній) функції епітелію, не пропускає їх до кровотоку, виводячи з організму з калом. У пацієнтів з хронічною хворобою нирок, дисбіоз призводить до порушення бар’єрної функції епітелію кишківника, так званого синдрому негерметичної кишки (leaky gut syndrome) та «протікання» уремічних токсинів і патогенів до кровоносних судин, розвитку хронічного запалення, прогресування xронічної хвороби нирок та серцево-судинних захворювань (рис. 1) [6, 7].
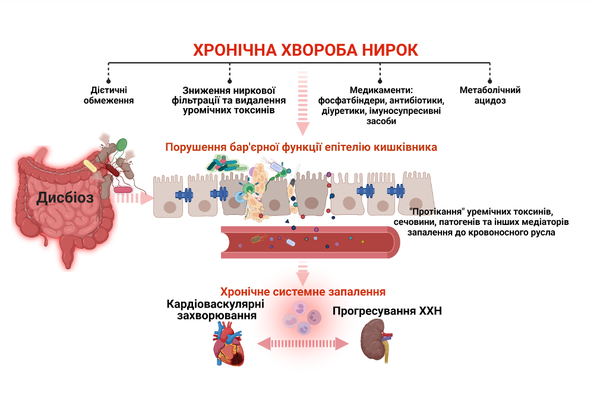
Рис. 1. Роль дисфункції кишкового бар'єру у прогресуванні хронічної хвороби нирок та серцево-судинних захворювань (Створено на BioRender.com).
Саме тому, порушення мікробіоти кишківника у пацієнтів з хронічною хворобою нирок асоційоване з хронічним запаленням, розвитком серцево-судинних захворювань та підвищеною смертністю. Визначення правильного балансу мікробіому кишечника може значно знизити рівень системного запалення та покращити здоров'я серцево -судинної системи. Вчені вважають, що маніпуляції з мікробіомом кишечника можуть істотно змінити майбутні підходи до медичної допомоги пацієнтам з хронічною хворобою нирок.
Попередні дослідження продемонстрували, що застосування пре- та пробіотиків покращує здоров'я шлунково-кишкового тракту людей з різними захворюваннями, у тому числі з хронічною хворобою нирок. У новому дослідженні, опублікованому в журналі «Ниркова дієта» Національного ниркового фонду, Мартін дель Кампо та її команда створили гель з пробіотичних бактерій (корисних лакто- та біфідо- бактерій) та пребіотиків (клітковина), які може вживати пацієнт на діалізі безпосередньо з упаковки, без додаткової води [8].
Результати дослідження показали покращення травних симптомів у хворих на діалізі. Серед інших симптомів спостерігалося зменшення блювоти, печії, болю в животі та частоти закрепів. Також виявилося, що пробіотичний гель покращує здатність організму поглинати поживні речовини та зменшує запалення [8].
Ми радимо пацієнтам проконсультуватись зі своїм нефрологом щодо можливого застосування пре- та пробіотиків.



